Un estudio con datos de 4.000 bebés ha demostrado que el análisis de ADN puede identificar hasta 120 patologías graves que el cribado neonatal estándar no detecta, esta técnica podría ser una opción más efectiva frente a los test convencionales.
El cribado es la realización de una prueba de diagnóstico genético a toda la población o a un grupo concreto para determinar si poseen algún gen o alteración cromosómica causante de una determinada enfermedad en ellos o en su descendencia.
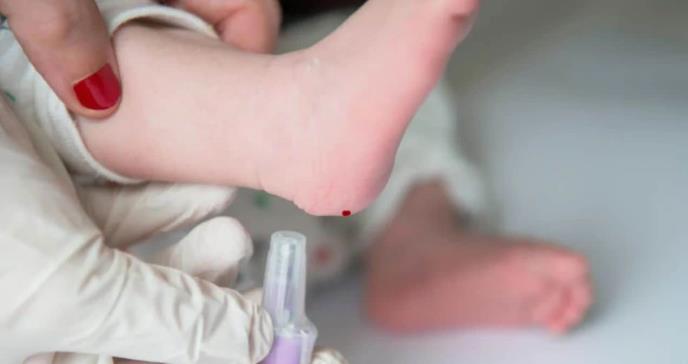
En el caso de cribado neonatal, se analiza una pequeña muestra de sangre que se obtiene pinchando el talón del recién nacido. Se suele hacer antes de que el bebé abandone el hospital, generalmente cuando el niño tiene uno o dos días de vida y se envía a un laboratorio para realizar pruebas para detectar un grupo de trastornos genéticos.
El estudio, llamado Guardian, es uno de los primeros estudios a gran escala del mundo que utiliza la secuenciación del genoma como método de cribado neonatal y es el primero en publicar resultados preliminares.
Los primeros resultados del estudio sobre métodos de detección de recién nacidos muestra que el análisis de ADN detecta muchas más enfermedades graves prevenibles o tratables que el cribado neonatal estándar.
Resultados impactantes
La secuenciación del genoma en recién nacidos permite detectar cientos de variantes genéticas que causan enfermedades. Esta tecnología puede identificar miles de enfermedades genéticas, superando los 60 trastornos detectados por la detección estándar actual.
En el estudio sobre 4.000 recién nacidos, se encontraron:
· 120 bebés (3%) con afecciones graves de salud.
· Solo 10 de estos casos fueron detectados mediante la detección estándar.
La mayoría de los niños a los que se les diagnosticó una enfermedad genética (92 de 120) tenían una deficiencia enzimática llamada deficiencia de glucosa-6-fosfato deshidrogenasa (G6PD). La G6PD no se incluye en la prueba tradicional, pero las personas con deficiencia de G6PD pueden tener reacciones moderadas o potencialmente mortales a ciertos alimentos y medicamentos que se pueden prevenir fácilmente si se los evita.
"Solo gracias a la evaluación genómica pudimos identificar a este niño a tiempo".
Un ejemplo notable es el de un niño que recibió un trasplante de médula ósea, después de que la secuenciación del genoma detectara una variante genética rara que causaba una grave inmunodeficiencia, no detectada por pruebas convencionales.
Según Milner, uno de los investigadores, un trasplante de médula ósea es una solución efectiva para estos niños, especialmente si se realiza en los primeros meses de vida.
"La secuenciación del genoma nos permite detectar cosas que causan enfermedades graves y tomar medidas para prevenirlas en una cantidad significativa de niños, no solo en unos pocos casos raros", dice Milner, quien también es el jefe de los servicios de alergia, inmunología y reumatología del NewYork-Presbyterian Morgan Stanley Children's Hospital.
Conclusiones del estudio
En general, el 3,7% de los niños del estudio dieron positivo en la secuenciación del genoma. Sin incluir la deficiencia de glucosa-6-fosfato deshidrogenasa (G6PD), que no se considera en el cribado estándar, la tasa de detección positiva fue del 0,6%, significativamente mayor que el 0,3% de las pruebas convencionales. Milner afirma que "una vez que se implemente este tipo de detección, este porcentaje aumentará a medida que agreguemos más enfermedades a la lista".
El estudio Guardian no solo destaca la eficacia de la secuenciación del genoma, sino que también abre un camino hacia un futuro donde las enfermedades raras puedan ser diagnosticadas y tratadas desde el nacimiento, mejorando así la calidad de vida de innumerables niños y sus familias.