Los hallazgos tienen implicaciones prometedoras para futuras terapias contra el cáncer y pueden orientar investigaciones en el desarrollo de tratamientos dirigidos.
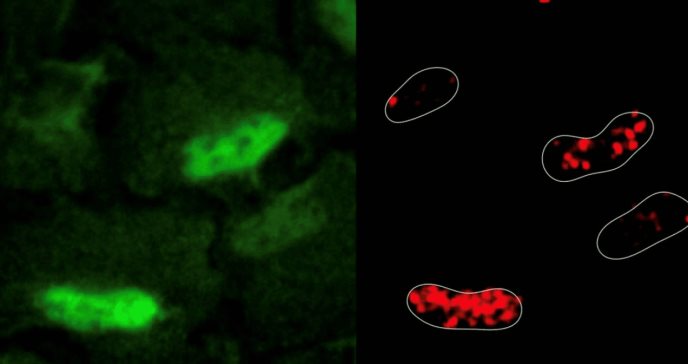
Una célula humana típica es metabólicamente activa, realiza numerosas reacciones químicas para convertir los nutrientes en energía y productos necesarios para la vida. Sin embargo, estas reacciones también generan especies reactivas de oxígeno, como el peróxido de hidrógeno, que pueden dañar el ADN de manera similar a cómo la oxidación afecta al metal.
Para proteger la integridad del genoma, se cree que las células controlan cuidadosamente la actividad metabólica, limitándola al citoplasma, las mitocondrias y evitando su presencia en el núcleo.
Enzimas antioxidantes
Las enzimas antioxidantes son cruciales para neutralizar las especies reactivas de oxígeno antes de que lleguen al ADN, protegiendo así los aproximadamente tres mil millones de nucleótidos de posibles mutaciones catastróficas. En caso de daño genético, las células detienen su actividad y se dedican a reparar el ADN, sintetizando nuevos componentes y llenando los vacíos.
A pesar de la importancia del metabolismo celular en el mantenimiento del genoma, no se ha realizado un estudio sistemático e imparcial sobre cómo las perturbaciones metabólicas afectan el daño y la reparación del ADN. Esto es especialmente relevante en enfermedades como el cáncer, donde se produce una apropiación de los procesos metabólicos y una proliferación celular sin restricciones.
Un equipo de investigadores, encabezado por Sara Sdelci del Centro de Regulación Genómica (CRG) en Barcelona y Joanna Loizou del Centro de Investigación de Medicina Molecular (CeMM) de la Academia Austriaca de Ciencias, realizó experimentos para identificar las enzimas y procesos metabólicos esenciales en la respuesta al daño del ADN. Los resultados de este estudio fueron publicados en la revista Molecular Systems Biology.
Fármaco de quimioterapia
Mediante el uso del fármaco de quimioterapia etopósido, los investigadores indujeron daño en el ADN de líneas celulares humanas. Este fármaco rompe las hebras de ADN y bloquea una enzima encargada de reparar el daño.
De manera sorprendente, la inducción de daño en el ADN provocó la generación de especies reactivas de oxígeno y su acumulación dentro del núcleo celular. Los investigadores observaron que las enzimas respiratorias celulares, una importante fuente de especies reactivas de oxígeno, se trasladaron de las mitocondrias al núcleo en respuesta al daño del ADN. Estos hallazgos representan un cambio de paradigma en la biología celular, ya que sugieren que el núcleo es metabólicamente activo.
"Donde hay humo hay fuego, y donde hay especies reactivas de oxígeno hay enzimas metabólicas en funcionamiento”, declaró Sdelci. “Históricamente, hemos pensado en el núcleo como un orgánulo metabólicamente inerte que importa todas sus necesidades del citoplasma, pero nuestro estudio demuestra que existe otro tipo de metabolismo en las células y se encuentra en el núcleo”, añadió.
Tecnología CRISPR-Cas9
Los investigadores emplearon la tecnología CRISPR-Cas9 para identificar todos los genes metabólicos cruciales para la supervivencia celular en este contexto. Estos experimentos revelaron que las células dirigen a la enzima antioxidante PRDX1, que normalmente se encuentra en las mitocondrias, para que se traslade al núcleo y elimine las especies reactivas de oxígeno presentes, evitando así daños mayores.
Además, se descubrió que PRDX1 repara el daño al regular la disponibilidad de aspartato en la célula, una molécula esencial para la síntesis de nucleótidos, los componentes fundamentales del ADN.
“PRDX1 es como un robot limpiador de piscinas. Se sabe que las células lo usan para mantener su interior ‘limpio’ y evitar la acumulación de especies reactivas de oxígeno, pero nunca antes a nivel nuclear. Esto prueba que, en un estado de crisis, el núcleo responde apropiándose de la maquinaria mitocondrial y establece una política de rápida industrialización de emergencia”, aseguró Sdelci.
Futuros avances oncológicos
Los hallazgos son clave para la investigación del cáncer. Fármacos como el etopósido dañan el ADN de las células tumorales e inhiben su reparación, induciendo la autodestrucción de las células cancerosas. Implicaciones prometedoras para futuras terapias anticancerígenas. Lo que puede orientar investigaciones futuras en el desarrollo de terapias dirigidas contra el cáncer.
Durante los experimentos, se descubrió que al eliminar genes metabólicos esenciales para la respiración celular, que es el proceso que genera energía a partir de oxígeno y nutrientes, las células sanas normales se volvieron resistentes al etopósido.
Este hallazgo es relevante debido a que muchas células cancerosas son glicolíticas, lo que significa que pueden generar energía incluso en presencia de oxígeno sin recurrir a la respiración celular. Por lo tanto, el etopósido y otras quimioterapias con un mecanismo similar pueden tener un efecto limitado en el tratamiento de tumores glicolíticos.
Se plantean nuevas estrategias
Los investigadores plantean la necesidad de explorar nuevas estrategias, como el tratamiento dual que combina el etopósido con fármacos que aumenten la generación de especies reactivas de oxígeno. Esta combinación podría superar la resistencia a los fármacos y acelerar la eliminación de las células cancerosas.
Además, se sugiere la hipótesis de que la combinación del etopósido con inhibidores de los procesos de síntesis de nucleótidos podría potenciar su efecto al prevenir la reparación del daño del ADN. De esta manera, se aseguraría que las células cancerosas se autodestruyan de manera adecuada.
Fuente consultada aquí.